11. Sınıf E Kare Kimya Ders 206-207-208-209-210-211 Cevapları

5. Ünite Değerlendirme Soruları
A- Aşağıdaki metinde numaralandırılmış boşlukları kutuda verilen kelimlerden uygun olanları ile tamamlayınız.
Bir kimyasal tepkimenin gerçekleşebilmesi için girenlerin çarpışmaları ve belirli bir enerji engelini aşmaları gerekir. Bu durum, çarpışma teorisi (1) ile açıklanır. Çarpışma teorisi iki şartın sağlanmasını gerektirir. Birincisi çarpışan moleküller yeterli enerjiye (2) yani yeterli hıza sahip olmalıdır. İkincisi de çarpışan moleküller birbirlerine göre uygun bir yönelmeye sahip olmalıdır. Eğer tepkimeye girenler yeterli enerjiye ve uygun yönelmeye sahipse etkin çarpışma (3) gerçekleşir ve bir tepkime meydana gelir. Tersine, tepkimeye girenler yeterli enerjiye ve uygun yönelmeye sahip değilse etkin olmayan çarpışma (4) gerçekleşir ve bir tepkime meydana gelmez. Tepkimenin gerçekleşebilmesi için girenlerin etkin çarpışmaları dışında belirli bir enerji engelini de aşmaları gerekir. Bu enerji engeli aktifleşme enerjisidir (5). Aktifleşme enerjisi girenler ile ürünler arasındaki bir potansiyel enerji (6) engelidir. Girenlerin ya da ürünlerin miktarının birim zamandaki değişimi tepkime hızı (7) olarak adlandırılır. Girenlerin ya da ürünlerin miktarı olarak derişimdeki (8), mol sayısındaki, kütledeki ya da gaz maddeler için normal şartlarda hacimdeki değişim değerleri kullanılır. Bu değişimlerden herhangi birinin zamandaki değişime bölünmesiyle tepkime hızı hesaplanır. Kimyasal tepkimelerin hızı incelenirken madde miktarındaki değişim olarak genellikle derişim birimi kullanılır. Buna göre tepkime hızının birimi de mol/L s (9) olarak ifade edilir. Bir kimyasal tepkimenin etkin çarpışma sayısını artıran faktörler tepkimenin hızını da artırmaktadır. Tepkime hızına etki eden faktörler şunlardır: Madde cinsi, derişim, sıcaklık (10), katalizör ve temas yüzeyidir.
B- Aşağıda verilen ifadeleri okuyunuz.İfadeler doğru ise "D" yanlış ise "Y" harfini işaretleyiniz.
1. Kimyasal tepkimelerde girenlerin bütün çarpışmaları bir tepkime ile sonuçlanır. (Y)
2. Etkin bir çarpışmada tepkimeye girenler belirli bir enerjiye ve uygun bir yönlenmeye sahip olmalıdır. (D)
3. Tepkimeye girenlerden ürünler oluşmadan önce tepkimeye giren moleküllerin bağlarının kısmen kırıldığı ve kısmen yenilerinin oluştuğu, yüksek enerjili ve kısa ömürlü bir ara hâl olan geçiş hâli oluşur. (D)
4. Kimyasal tepkimelerde yüksek enerjili ve kısa ömürlü ara ürün aktifleşmiş kompleks olarak adlandırılır. (D)
5. Tepkimeye girenlerin fiziksel hâllerinin farklı olduğu tepkimeler homojen tepkimelerdir. (Y)
6. Bir tepkimenin hız ifadesinde yer alan “k”nin sayısal değeri tepkimeye girenlerin derişimine bağlıdır. (Y)
7. Çok basamaklı tepkimelerde hız belirleyen basamak yavaş basamaktır. (D)
8. Katalizörler tepkimenin aktifleşme enerjisini azaltarak tepkimenin hızını artırır. (D)
C- Aşağıdaki soruları cevaplayınız.
1. Kimyasal tepkimeler ile tepkimeye giren kimyasal türlerin çarpışmaları arasında nasıl bir ilişki olduğunu açıklayınız.
Cevap: Kimyasal olarak baktığımızda her tepkime farklı sürelerde gerçekleşir. Kimya biliminde tepkime hızları çok önemli ve büyük bir konudur. Kimya biliminde tepkime hızlarıyla ilgilenen dalına tepkime kinetiği denilir. Hızın genel tanımı kimya özelinde herhangi bir değişiklik göstermez ve “birim zamanda madde miktarındaki değişime” tepkime hızı denilir. Bir kimyasal tepkimenin başlangıç anında ilk önce giren maddelerin yoğunluğu çok olduğu için tepkime hızlı başlar ancak (giren maddelerin yoğunluğu azaldığı için) yavaşlayarak devam eder.
2. Aktifleşme enerjisi nedir? A2 + B2 — 2AB gibi genel bir tepkimeye ilişkin potansiyel enerji-tepkime koordinatı grafiği üzerinde, ileri ve geri aktifleşme enerjisi ile tepkime entalpisini göstererek açıklayınız.
Aktifleşme enerjisi: Bir kimyasal tepkimenin başlaması için reaktanların aşması gereken minimum enerjidir.
Potansiyel enerji-tepkime koordinatı grafiği: Tepkimenin ilerlemesi boyunca reaktanların, aktifleşmiş kompleksin ve ürünlerin potansiyel enerjisini gösteren bir grafiktir.
A2 + B2 → 2AB tepkimesi için:
- Aktifleşme kompleksi, reaktanlardan daha yüksek potansiyel enerjiye sahiptir.
- Ea (ileri): Aktifleşme kompleksi oluşumu için gereken enerjidir.
- Ea (geri): Ürünlerden reaktanlara dönüşmek için gereken enerjidir.
- ΔH: Tepkimenin entalpisidir. Ürünlerin potansiyel enerjisi ile reaktanların potansiyel enerjisi arasındaki farktır.
3. Tepkime hızına etki eden faktörler nelerdir? Bu faktörlerin tepkime hızına etkisini kısaca açıklayınız?
Madde Cinsi: Tepkime sırasında reaktif maddelerde bağ koparılıp yeni bağ oluşuyorsa tepkimeler yavaş, bağ kopması yoksa (iyonik tepkimeler) tepkime hızlıdır.
Sıcaklık: Sıcaklık arttırılırsa, Kinetik enerji artar. Eşik enerjisine sahip tanecik sayısı artar. Tanecik hızı artar. Etkin çarpışma yapan tanecik sayısı artar. Birim zamanda çarpışan tanecik sayısı artar. Aktifleşmiş kompleks sayısı artar. Tepkime hızı artar. Aktifleşme enerjisi değişmez.
Temas Yüzeyi: Heterojen tepkimelerde katı madde küçüldüğünde temas yüzeyi artar, bunun sonucu birim zamandaki çarpışma sayısı artacağından tepkime hızı artar. Odun talaşının odundan daha hızlı yanması, plaka de- mirin, toz demirden daha geç paslanması bu yüzdendir.
Derişim – Basınç: Tepkime kabının hacmi büyütülüp veya küçültülürse, birim zamandaki çarpma sayısı değişeceğinden tepkime hızı değişir.
Katalizör: Tepkime hızının artmasına neden olan maddedir. Yapı- lan işleme ise kataliz denir.
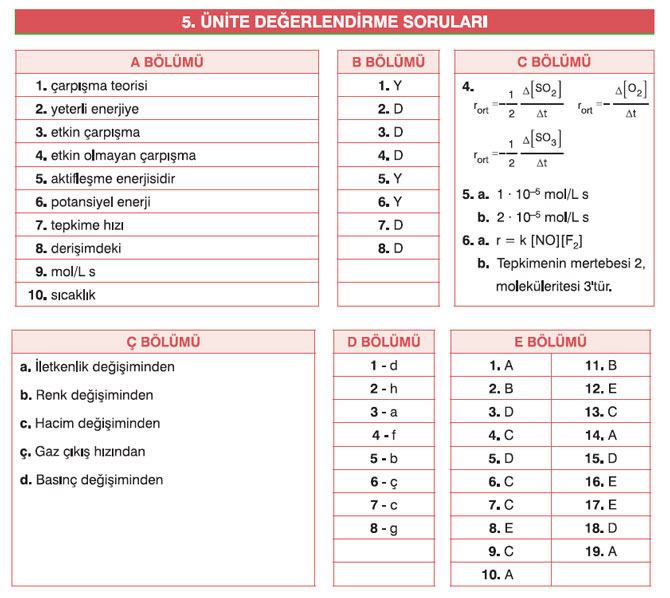
4. 2S02(g) + 02(g) — 2S03(g) tepkimesinde her bir maddenin ortalama hız ifadesini yazınız.
5. 5 L’lik tepkime kabına 0,56 g N2 gazı ve yeterince H2 gazı konularak aşağıdaki tepkime gerçekleştiriliyor: N2(g) + 3H2(g) — 2NH3(g)
200 saniye sonunda tepkimede 0,28 g N2 gazı bulunduğuna göre;
a) Tepkimede N2 gazının ortalama harcanma hızını hesaplayınız (N: 14 g/mol).
Cevap: 1 ∙ 10–5 mol/L s
b) Tepkimede NH3 gazının ortalama oluşma hızını hesaplayınız.
Cevap: 2 ∙ 10–5 mol/L s
6. 2NO(g) + F2(g) —- 2NOF(g) tepkimesine ilişkin deneysel sonuçlar aşağıda verilmiştir.
Buna göre aşağıdaki istenilenleri cevaplayınız.
a) Tepkimenin hız denklemini yazınız.
Cevap: r = k [NO][F2]
b) Tepkimenin mertebesini ve moleküleritesini belirtiniz.
Cevap: Tepkimenin mertebesi 2, moleküleritesi 3’tür.
Ç. Aşağıdaki tabloda verilen tepkimeleri inceleyiniz. Tepkimelerde hızın ölçümünde kullanılabilecek değişimi yazarak nedenini kısaca açıklayınız.
| Tepkime | Tepkime hızının ölçümünde kullanılabilecek değişim | Neden? |
|---|---|---|
| a. H+(suda) + OH–(suda) → H2O(s) | pH | Tepkimenin hızı, hidrojen iyonu (H+) ve hidroksil iyonu (OH-) konsantrasyonlarının değişimiyle ilişkilidir. Bu nedenle, pH değeri tepkimenin hızını ölçmek için kullanılabilir. |
| b. 2NO(g) + O2(g) → 2NO2(g) | Renk değişimi | Tepkime sırasında renk değişimi oluşur. Bu renk değişimi, nitrojen monoksit (NO) gazının renksiz olduğu halde, azot dioksit (NO2) gazının açık kahverengi renkte olmasıyla gözlemlenebilir. Bu renk değişimi, tepkimenin hızını görsel olarak izlemek için kullanılabilir. |
| c. C2H2(g) + 2H2(g) → C2H6(g) (P, T sabit) | Hacim değişimi | Tepkime sırasında gaz hacmi değişimi olmaz. Ancak, reaktanların veya ürünlerin basınçlarındaki değişimler, tepkimenin hızını ölçmek için kullanılabilir. |
| ç. Fe(k) + 2HCl(suda) → FeCl2(suda) + H2(g) | Gaz hacmi veya basınç değişimi | Tepkime sırasında gaz hacmi veya basınç değişimi oluşur. Bu değişimler, tepkimenin hızını ölçmek için kullanılabilir. |
| d. 2SO2(g) + O2(g) → 2SO3(g) (V, T sabit) | Gaz hacmi değişimi | Tepkime sırasında gaz hacmi değişimi olur. Bu değişim, tepkimenin hızını ölçmek için kullanılabilir. |
D- Aşağıda verilen ifadeleri kavramlarla eşleştiriniz.
| İfade | Kavram | Eşleştirme |
|---|---|---|
| 1. Bir tepkime vermek üzere yeterli enerjiye ve uygun bir yönnelmeye sahip moleküller arasında gerçekleşir. | d. Etkin çarpışma | 1-d |
| 2. Bir çarpışmada tepkime oluşabilmesi için gerekli olan en düşük enerjidir. | h. Aktifleşme enerjisi | 2-h |
| 3. Girenlerin ya da ürünlerin miktarının birim zamandaki değişimidir. | a. Tepkime hızı | 3-a |
| 4. Tepkimeye girenlerin ürünlere dönüşmesinin yer aldığı ara basamaklar serisidir. | f. Tepkime mekanizması | 4-f |
| 5. Tepkime ortamına eklendiğinde tepkimenin daha düşük aktifleşme enerjili bir yol izlemesini sağlayarak tepkime hızını artıran ve tepkimede değişmeden çıkan maddedir. | b. Katalizör | 5-b |
| 6. Girenlerin ya da ürünlerin derişiminin belirli bir zaman aralığındaki değişim hızıdır. | ç. Ortalama hız | 6-ç |
| 7. Hız sabitine ve tepkimeye girenlerin derişimlerinin üstel kuvvetlerine bağlı olduğunu ifade eden eşitliktir. | c. Hız denklemi | 7-c |
| 8. Herhangi bir basamakta oluşan, sonraki basamaklarda harcanarak tepkimede rol oynayan fakat net tepkimede yer almayan maddelerdir. | g. Tepkime ara ürünü | 8-g |
E- Aşağıda verilen çoktan seçmeli soruları cevaplayınız

Yorumların her türlü cezai ve hukuki sorumluluğu yazan kişiye aittir. Eğitim Sistem yapılan yorumlardan sorumlu değildir.